Paso 1: Coeficientes y subíndices
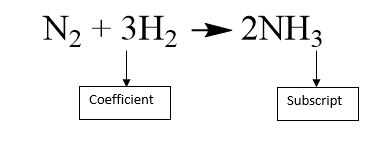
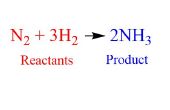
Al acercarse a una ecuación química, es importante que usted comprenda la diferencia entre los coeficientes y subíndices. El coeficiente se coloca frente a una molécula, mientras que el subíndice sigue ciertos átomos, como se muestra en la primera foto.
En una molécula, el coeficiente indica la cantidad de presente la molécula. El subíndice de un átomo indica la cantidad de ese átomo en la molécula. Por ejemplo, en la primera foto el coeficiente para el segundo término indica que 3 moléculas de H2 están presentes, y el subíndice del primer término significa que 2 átomos de nitrógeno (N) están presentes por la molécula de N2.
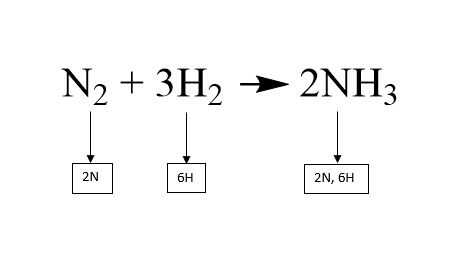
Agregar un coeficiente delante de una molécula multiplica todos los átomos de esa molécula por el número del coeficiente. Si un átomo tiene un subíndice, el coeficiente y el subíndice se multiplican para obtener la cantidad total de ese átomo en la molécula. Por ejemplo, en la segunda foto, el coeficiente para el amoníaco (NH3) en el lado de los productos es de 2. El 2 se multiplica por el subíndice del hidrógeno que es 3, que rinde un número total de átomos de hidrógeno iguales a 6.
El coeficiente es la parte que puede ser cambiada y añadida al balanceo de una ecuación. Cambio el coeficiente cambia el número total de esa molécula. El subíndice, sin embargo, no puede cambiarse. Alterar un subíndice cambiaría la molécula sí mismo.