Paso 4: Equitación química y explicación
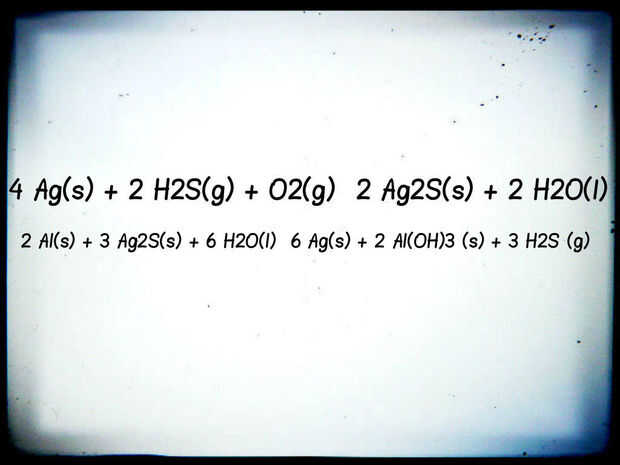
Bien... en este proyecto podemos ver otro uso de reacciones Red-Ox pero el fuego de la iluminación.
El fenómeno de plata ennegrecido es causado por un contaminante en el aire llamado sulfuro de hidrógeno (H2S) y que nos lleva a nuestra primera equitación: 4 Ag(s) + 2 H2S(g) + O2(g) → 2 Ag2S(s) + 2 H2O(l)
Se trata de una reacción Red-Ox entre la plata a H2S, las vueltas de plata Ag2S y es la "suciedad" que vemos en la plata.
Ahora, para limpiar la plata tenemos que volver el Ag2S en parte posterior de la Ag, para ello vamos a utilizar un mejor metal reductor (reductor es la sustancia en la reacción que da electrones) que la plata, como el aluminio, que se oxida, igual que la plata fue. La equitación aquí está:
2 Al(s) + 3 Ag2S(s) + H2O(l) 6 → 6 Ag(s) + 2 Al (OH) 3 (s) + 3 H2S (g)
Como podemos ver Al comienza como un sólido y se convierte en Al (OH) 3 y la plata, que se inició como Ag2S se convierte en Ag.
El olor a azufre que se nota durante el proceso es olor de H2S.
Ahora se levanta una pregunta: ¿por qué utilizamos el bicarbonato de sodio???
Bicarbonato de sodio tiene dos papeles aquí:
En primer lugar, es una sustancia de limpieza de la plata.
En segundo lugar, el sodio es una base a diferencia de sulfuro de hidrógeno que es ácido. El bicarbonato neutraliza el ácido y previene contra el daño de la plata. Esto sucede en la reacción:
H2S (aq) + NaHCO3 (aq) -> NaHS (aq) + CO2 (g) + H2O (l)
Después de esta reacción estamos dejamos con agua, dióxido de carbono e hidrosulfuro del sodio que no dañará la plata.













