Paso 6: Análisis establecer
Preparar los estándares por tomar la menor concentración de ADN para evitar cualquier contaminación. Comienzan con 11 estándar y cierre la tapa.
1 25ul 2.0ng /ul estándar + 75ul 1 X TE
2 20ul 2.0ng / ul estándar + 80ul 1 X TE
3 15ul 2.0ng / ul estándar + 85ul 1 X TE
4 10ul 2.0ng / ul estándar + 90ul 1 X TE
5 5ul 2.0ng / ul estándar + 95ul 1 X TE
6 3ul 2.0ng / ul estándar + 97ul 1 X TE
7 1ul 2.0ng / ul estándar + 99ul 1 X TE
8 0.5ul 2.0ng / ul estándar + 99.5ul 1 X TE
9 1ul 0.2 ng/ul estándar + 99ul 1 X TE
10 0.5ul 0.2ng / ul estándar + 99.5ul 1 X TE
100ul 11 1 X TE
Muestra configurar
La mayor concentración que pueden leer los procedentes es 0.2ug. Si el ADN se sabe para ser más altas de 0.2ug, realizar las diluciones necesarias para obtener una concentración de ADN menor de 0.2ug. Siempre realizar al menos una 1:20 dilución de las muestras de ADN . Si está trabajando con gran concentración de ADN (500ng/ul), una dilución 1: 200 debe ser fineza.
1. añadir 95ul de tampón TE de X 1 a todos los tubos de muestras (incluyendo su duplicado/triplicado tubo).
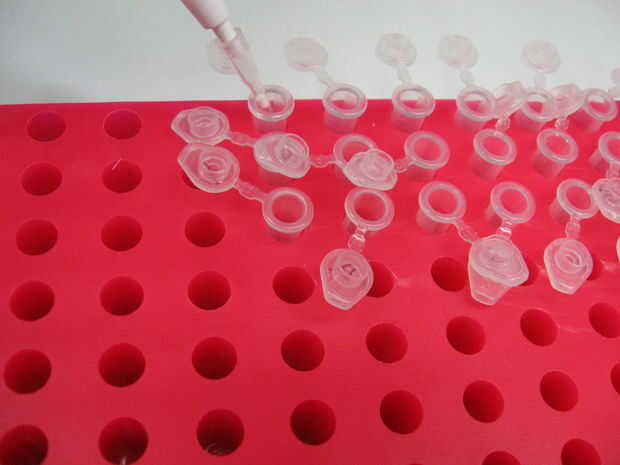
2. agregar 5ul de la muestra de ADN diluida a la 95ul 1 X TE tubos. Dispensar la pipeta tubo después de cada alícuota de DNA (Figura 1). Debe existir un volumen total de 100ul en este punto.
3. apagar la luz de la campana molecular
4. agarrar el picogreen
6. con la pipeta del reactivo de 1000ul, añadir 8520ul de 1 x de buffer de TE en cada tubo Picogreen
7. brevemente vortex Picogreen todos los tubos para mezclar
8. si es posible, centrifugar los tubos picogreen
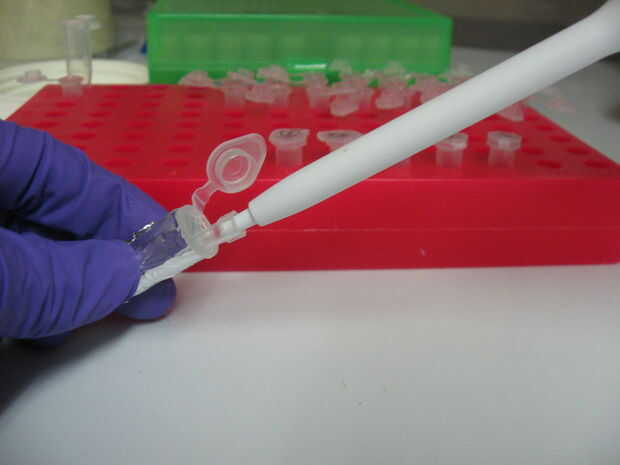
9. alícuota 100ul de Picogreen (con una punta de pipeta nueva para cada alícuota) a todos los 161 tubos (Figura 2) a partir de la norma más baja (100ul TE X 1). Tapa los tubos después de cada alícuota picogreen.
a. el tubo Picogreen debe contener suficiente Picogreen 42 muestras; vaciar el tubo.
10. coge otro Picogreen tubo y repita el paso 9 hasta que todas las muestras de ADN incluidas las normas han recibido 100ul de picogreen