Paso 2: Resumen: conversión de jabones de ácidos grasos
Na C17H35COO
y se escribe la reacción que describe el equilibrio de estearato de sodio con sus iones constitutivos
NaC17H35COO → Na+ + C17H35COO–
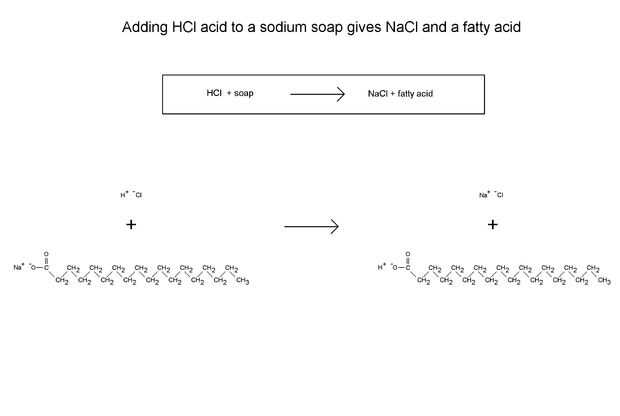
El proceso de acidificación de un jabón para obtener un ácido graso, es esencialmente una reacción de intercambio. Quiero intercambiar los iones de Na+ de jabón con los iones de H+ . Suponiendo que utilizar ácido clorhídrico, HCl, como mi fuente de H+
Ácido clorhídrico + NaC17H35COO → NaCl + C17H35COOH
El Na+ y H+ los lugares. Na+ deja el anión graso, por lo que se pueda ser amigos con Cl– en solución, y al mismo tiempo H+ se une con el anión graso, haciendo que una molécula con un grupo COOH en un extremo, un ácido graso. El ácido graso no es souble en agua a pH bajo (ácido), por lo que «cuelga hacia fuera». Reúne en gotitas y flota sobre la solución acuosa (agua) más pesada.
Las ecuaciones de ejemplo sobre que he escrito son para estearato de sodio reaccionaron con HCl. Las reacciones de otros jabones, como sodio palmeada y oleato de sodio, son exactamente iguales. El ión Na + entra en solución, y un ácido graso en COOH se bloquea hacia fuera.
Diferentes ácidos grasos (estearato, palmeada, oleato) son miscibles en uno otro, así que una mezcla de jabones de acidificación dará una mezcla de ácidos grasos.
Y esto es lo que espero obtener como resultado de la acidificación mi jabón de barra de Ivory(r). Esta barra de material, comúnmente llamado "jabón" es realmente una mezcla de varios jabones de sodio diferentes. Ver sección 3 de la MSDS adjunta para el jabón de Ivory(r). Es una mezcla porque el sebo utilizado para hacerlo es en sí mismo, una mezcla de tryglycerides. Del mismo modo el resultado final después de la acidificación de esta pastilla de jabón es una mezcla de ácidos grasos, también llamada mezcla de ácidos grasos, también llamado FAM.













