Paso 4: Los iones e isótopos
En el proceso de mezcla con otros átomos, algunos átomos pierden sus electrones, y algunos ganan electrones más. Átomos con 3 o menos electrones en su capa exterior se mueven fácilmente.
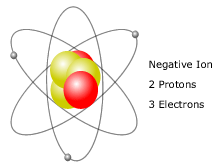
Ion negativo es cuando un átomo tiene más electrones que sus protones.
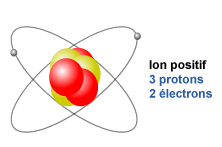
Ion positivo es cuando un átomo tiene más protones que sus electrones.
Otra característica interesante de elementos/átomos en su composición atómica sub es el isótopo. Para determinar que un átomo del mismo elemento (por ejemplo carbón) deben tener el mismo número protones. Carbono tiene 6 protones. Por consiguiente, un átomo con 6 protones y 6 neutrones es también el carbón, concretamente un isótopo de carbono, o en otras palabras variación del átomo de carbono de base (con sólo 6 protones).
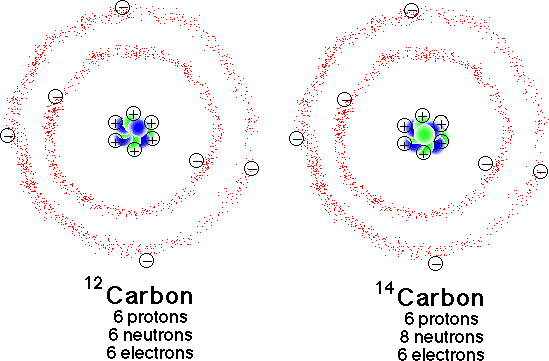
Por lo tanto, un isótopo es un átomo que es una variación de otro átomo con los protones de la misma. Considerar el carbono 12 y carbono-14 en las imágenes.
Carbono 12, tiene 6 protones
Carbono 14 tiene 6 protones
---la diferencia entre estos 2 isótopos puede verse en su número de neutrones.
Carbono 12 tiene 6 neutrones
Carbono 14 tiene 8 neutrones.
Carbono 12 y carbono-14 son isótopos de carbono.
También por lo general, cuando hay 6 protones, también habrá 6 electrones, en un átomo neutral cargado.
Esta parte de la Conferencia es sólo para su información y no requiere memorización.













