

Oxígeno
El oxígeno es un elemento químico de número atómico 8 y símbolo O. Es un miembro del grupo de halógenos de la tabla periódica y es un elemento no-metálico altamente reactivo y oxidante que fácilmente forma compuestos (especialmente óxidos) con la mayoría de los elementos. Fotosíntesis libera oxígeno, y la respiración consume oxígeno. Cambios en fosfato están relacionados con cambios en las concentraciones de oxígeno.
Oxígeno fue descubierto independientemente por Joseph Priestley en Wiltshire, en 1774 y el Carl Wilhelm Schele, en Upsala, en 1773, o antes, pero Priestley a menudo tiene prioridad porque su trabajo fue publicado primero. El oxígeno del nombre fue acuñado en 1777 por Antoine Lavoisier, cuyos experimentos con oxígeno ayuda a desacreditar la teoría de phlogiston entonces-popular de la combustión y la corrosión. Su nombre deriva de las raíces griegas oxys, "ácido", literalmente "agudos", refiriéndose al sabor agrio de los ácidos y - γενής-genes, "productor", literalmente "begetter", porque en el momento del nombramiento, fue erróneamente pensó que todos los ácidos requieren oxígeno en su composición.
Se emplean dos métodos principales para producir 100 millones de toneladas de O
2 extraído de aire para usos industriales anualmente. El método más común es marginalmente destilar aire licuado en sus diferentes componentes, con N 2 destilación como un vapor, mientras que el O 2 se queda como un líquido. El otro método principal de producción de gas O 2 consiste en pasar una corriente de aire limpio y seco a través de una cama de un par de tamices moleculares de zeolita idénticos, que absorbe el nitrógeno y entrega una corriente de gas que es 90% a 93% O 2.Simultaneously, se libera el gas nitrógeno de la cama de zeolita saturada de nitrógeno, reduciendo la presión de cámara y desviar parte de los gases de oxígeno desde la cama del productor a través de él , en el sentido contrario del flujo. Después de un determinado ciclo de tiempo el funcionamiento de las dos camas es intercambiar, lo que permite un suministro continuo de oxígeno gaseoso para ser bombeado a través de una tubería. Esto se conoce como adsorción del oscilación de la presión. Oxigeno gaseoso se obtiene cada vez más por estas tecnologías no-criogénicos (véase también la adsorción del oscilación de vacío relacionados). Gas de oxígeno puede también ser producido por electrólisis del agua en hidrógeno y oxígeno molecular. Eléctrica de CC debe ser utilizado: si se usa AC, los gases en cada miembro consisten en hidrógeno y oxígeno en la explosiva relación 2:1. Contrariamente a la creencia popular, el cociente de 2:1 observado en la electrólisis de la C.C. de agua acidificada no prueba que la fórmula del agua es H2O si ciertas suposiciones se hicieron sobre las fórmulas molecular de hidrógeno y oxígeno. Un método similar es electrocatalítica O 2 evolución de los óxidos andoxoacids. Catalizadores químicos pueden ser utilizado también, como en generadores químicos de oxígeno u oxígeno velas que se utilizan como parte del equipo de soporte de vida en submarinos y siguen siendo parte del equipo estándar en aviones comerciales en caso de emergencias de despresurización. Otra tecnología de separación de aire implica forzar aire para disolver a través de las membranas de cerámica basadas en dioxideby de circonio sea alta presión o una corriente eléctrica, para producir gas O 2 casi puro. En grandes cantidades, el precio del oxígeno líquido en 2001 fue de aproximadamente $ 0,21/kg. Puesto que el principal costo de producción es el costo energético de licuar el aire, el coste de producción va a cambiar como costo de energía varía.
Hidrógeno
Hidrógeno es un elemento químico con símbolo químico H y número atómico 1. Con un peso atómico de 1.00794 u, el hidrógeno es el elemento más ligero de la tabla periódica. Su forma monatomic (H) es la sustancia química más abundante en el universo, constituyendo aproximadamente el 75% de la masa bariónica todos. Remanente no estrellas se componen principalmente de hidrógeno en su estado de plasma. El isótopo más común del hidrógeno, denominado protio (nombre utilizado raramente, símbolo 1H), tiene un protón y no hay neutrones.
La aparición universal del hidrógeno atómico primero ocurrió durante la época de recombinación. A presión y temperatura estándar, el hidrógeno es un gas diatómico incoloro, inodoro, insípido, no tóxico, no-metálico, altamente combustible con la fórmula molecular H2. Puesto que el hidrógeno fácilmente forma compuestos covalentes con elementos más no metálicos, la mayoría del hidrógeno en la tierra existe en formas moleculares como en forma de agua o compuestos orgánicos. Hidrógeno desempeña un papel particularmente importante en las reacciones ácido – base como muchas reacciones ácido-base implican el intercambio de protones entre moléculas solubles. En compuestos iónicos, el hidrógeno puede tomar la forma de una carga negativa cuando se conoce como un hidruro, o como una especie cargada positivamente denotada por el símbolo H +. El catión hidrógeno se escribe como si compuesto de un protón desnudo, pero en realidad, cationes de hidrógeno en los compuestos iónicos son siempre especies más complejas que eso sugeriría. Como el átomo sólo neutral para que la ecuación de Schrödinger puede resolverse analíticamente, el estudio de la energética y la Unión del átomo del hidrógeno ha desempeñado un papel clave en el desarrollo de la mecánica cuántica. El gas de hidrógeno primero fue producido artificialmente en el siglo XVI, a través de la mezcla de metales con ácidos. En 1766 – 81, Henry Cavendish fue el primero en reconocer que el gas de hidrógeno es una sustancia discreta, y que produce el agua cuando se quema, una propiedad que más adelante le dio su nombre: en griego, hidrógeno significa "formador de agua". La producción industrial es principalmente el vapor reforming de gas natural y menos a menudo de más métodos de producción de hidrógeno de alto consumo energético como la electrólisis del agua. La mayoría del hidrógeno se emplea cerca de su sitio de producción, con los dos usos más grande producción procesamiento y amoníaco de combustibles fósiles, sobre todo para el mercado de fertilizantes. Hidrógeno es una preocupación en la metalurgia ya que puede embrittle muchos metales, que complica el diseño de tuberías y tanques de almacenamiento
En el laboratorio, H
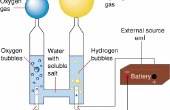
2 generalmente es preparado por la reacción de ácidos diluidos no oxidantes en algunos metales reactivos como el cinc con el aparato de Kipp. Zn + 2 H + → Zn2 + + H 2Aluminium puede también producir H 2 sobre el tratamiento con bases: 2 Al + 6 H 2O + 2 OH− → 2 Al (OH) − 4 + 3 H 2 electrólisis del agua es un método simple de producir hidrógeno. Una corriente de baja tensión se ejecuta a través del agua y formas de oxígeno gaseoso en el ánodo mientras que formas de hidrógeno gaseoso en el cátodo. Normalmente el cátodo está hecho de platino u otro metal inerte al producir hidrógeno para el almacenamiento. Si, sin embargo, el gas es quemado en el sitio, oxígeno es deseable para ayudar a la combustión, y así se haría ambos electrodos de metales inertes. (Hierro, por ejemplo, se oxida y así disminuir la cantidad de oxígeno que desprende) La eficiencia máxima teórica (utilizado vs valor energético del hidrógeno producido electricidad) está en la gama 80 – 94%.2 H 2O(l) → 2 H 2.g + O 2 (g) en 2007, se descubrió que una aleación de aluminio y galio en forma de pellet agua podría usarse para generar hidrógeno. El proceso también crea alúmina, pero el galio caro, que previene la formación de una piel de óxido en los pellets, puede ser reutilizado. Esto tiene importantes consecuencias potenciales para una economía del hidrógeno, como el hidrógeno se puede producir en el sitio y no necesita ser transportado.
Cloro
El cloro es un elemento químico con símbolo Cl y número atómico 17. El cloro es el halógeno del grupo y es el segundo halógeno más ligero después de flúor. El elemento es un gas amarillo verdoso bajo condiciones estándar, donde forma moléculas diatómicas. Cloro tiene la mayor afinidad del electrón y la tercera más alta Electronegatividad de todos los elementos reactivos. Por esta razón, el cloro es un agente oxidante fuerte. Cloro libre es raro en la tierra y es generalmente un resultado de byoxygen de oxidación directa o indirecta.
El compuesto más común de cloro, cloruro de sodio (sal común), se ha sabido desde épocas antiguas. Alrededor 1630, gas de la clorina era primero sintetizado en una reacción química, pero no se reconoce como una sustancia fundamental. Caracterización del gas de cloro fue realizada en 1774 por Carl Wilhelm Scheele, que se supone que es un óxido de un nuevo elemento. En 1809, químicos sugirieron que el gas podría ser un elemento puro, y esto fue confirmado por Sir Humphry Davy en 1810, que nombre del griego antiguo "verde pálido". Cloro casi todo en la corteza terrestre se produce como cloruro en varios compuestos iónicos, como sal de mesa. Es el segundo más abundante halógeno y 21 elemento químico más abundante en la corteza terrestre. El cloro elemental es frombrine comercialmente producido por electrólisis. El gran potencial oxidante del cloro elemental led comercialmente libre clorina blanqueo y usos desinfectantes, así como sus usos de un reactivo esencial en la industria química. Cloro se utiliza en la fabricación de una amplia gama de productos de consumo, alrededor de dos tercios de los productos químicos orgánicos tales como cloruro de polivinilo, así como muchos productos intermedios para la producción de plásticos y otros productos finales que no contienen el elemento. Como un desinfectante común, se utilizan cloro elemental y compuestos generadores de cloro más directamente en las piscinas para mantenerlos limpios y desinfectados. En forma de iones de cloruro, el cloro es necesario para todas las especies conocidas de la vida. Otros tipos de compuestos de cloro son raras en los organismos vivos y producción artificialmente compuestos orgánicos clorados entre inertes y tóxicos. En la atmósfera superior, moléculas orgánicas que contienen cloro como los clorofluorocarburos se han implicado en el agotamiento del ozono. Pequeñas cantidades de cloro elemental son generadas por la oxidación del cloruro a hipoclorito en neutrófilos, como parte de la respuesta inmune contra las bacterias. Cloro elemental a altas concentraciones es muy peligroso y venenoso de todos los organismos vivos y fue utilizado en primera guerra mundial como el primer agente de guerra química gaseosa.
En la industria, cloro elemental es generalmente producido por electrólisis de cloruro de sodio disuelto en agua. Este método, el proceso del chloralkali en 1892, ahora ofrece esencialmente todos los gases de cloro industrial. Junto con el cloro, el método produce gas de hidrógeno e hidróxido de sodio (con hidróxido de sodio siendo realmente la más importante de los tres productos industriales producidos por el proceso). El proceso se desarrolla según la siguiente ecuación química:
2 NaCl + 2 H2O → Cl2 + H2 + 2 NaOHThe electrólisis de soluciones de cloruro todos proceden según las siguientes ecuaciones: cátodo: 2 H+(aq) + 2 e− → H2 (g) ánodo: 2 Cl−(aq) → Cl2(g) + 2 e−Overall proceso: 2 NaCl (o KCl) + 2 H2O → Cl2 + H2 + 2 NaOH (o KOH) en diafragma de electrólisis, asbesto (o fibra de polímero) de celda de diafragma separa un cátodo y un ánodo , evitando el cloro que se forman en el ánodo de volver a mezclar con el hidróxido de sodio y el hidrógeno formado en el cátodo. La solución de sal (salmuera) se alimenta continuamente al compartimiento del ánodo y fluye a través del diafragma al compartimiento del cátodo, donde se produce el álcali cáustico y la salmuera es parcialmente agotada. Métodos de diafragma producen álcali diluido y ligeramente impuro pero ellos no cargan con el problema de prevenir el vertido de mercurio en el medio ambiente y son más eficientes. Electrólisis de membrana celular emplean membrana permeable como un intercambiador de iones. Solución saturada de cloruro de sodio (o potasio) se pasa a través del compartimiento del ánodo, dejando a una concentración menor. Este método es más eficiente que la celda de diafragma y produce hidróxido de sodio (o potasio) muy puro en alrededor del 32% de concentración, pero requiere salmuera muy puro.