Paso 2: Quimioluminiscencia de oxígeno de la camiseta: la versión larga, técnica (fondo)
La hebilla de su cinturón de seguridad y mantenga a sus botas. Tiempo de algunas Ciencias.
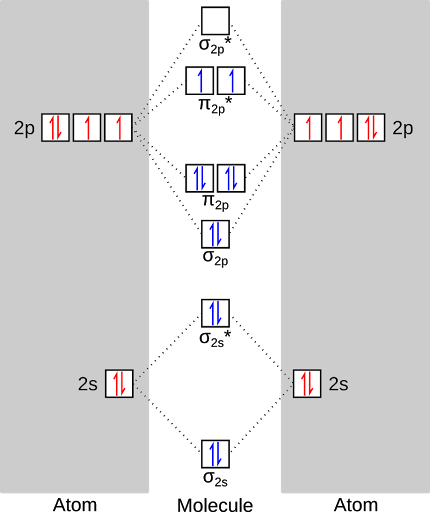
Primero, algunos términos y definiciones. El diagrama siguiente es un Diagrama de orbital molecular para el oxígeno. Esto es una forma de representar gráficamente los niveles de energía (orbitales) disponibles para los electrones llenar en una molécula. Las cajas a la izquierda y la derecha representan los orbitales atómicos que cada átomo de oxígeno contribuye a la molécula. Está etiquetado como s (con forma de una esfera) y p (en forma de un cacahuete). En el centro están los orbitales moleculares que se forman cuando los orbitales atómicos interactúan entre sí. Están rotuladas σ (sigma, en forma de una salchicha) y π (pi, en forma de, bueno, dos π pegado-al-pies). el show de asteriscos que son orbitales "antibonding" - son justo lo que suenan como y efectivamente "anular" un bono. Hay reglas para qué orbitales atómicos pueden "mezclar" y que no se puede pero eso lo dejaré para otro día.
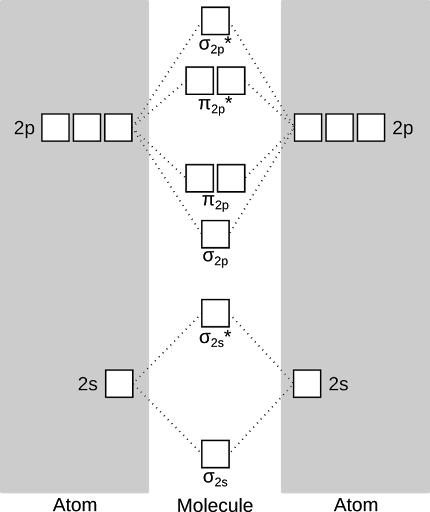
OK - ahora que ya tenemos los niveles de energía todo trazados, podemos llenar luego con electrones. Hay algunas reglas para esto, sin embargo, será relevante más adelante! Ellos son, en orden:
1. El principio de Afbau: electrones llenan Estados de energía más baja antes de Estados de mayor energía. En un átomo o una molécula, menor energía de un electrón significa cerca de un núcleo atómico. Núcleos están llenos de protones y atraen electrones con carga negativa.
2. regla de Hund: si hay niveles de energía que son iguales en energía (llamada "degenerar", pero no de la misma manera como su compañero de habitación), llenar todos ellos con un electrón antes de alguno de ellos obtiene dos electrones. Esto es porque los electrones de carga negativa repelen otros electrones de carga negativa. Mucho como los niños, requiere menos energía cuando cada electrón tiene su propia habitación. Electrones también tienen una propiedad llamada 'spin', que puede pensar como los polos de un imán - electrones pueden "vuelta para arriba" (polo norte hacia arriba) o "desactivación" (polo norte hacia abajo) como imanes lugar próximo uno al otro, electrones en orbitales degenerados tienden a tener idénticos giros.
3. el principio de exclusión de Pauli: electrones no pueden tener conjuntos idénticos de números cuánticos. Básicamente, cuando se rellena estos niveles de energía con electrones, hay valores asociados con algunas de las propiedades de los electrones. Sin entrar en demasiado detalle, esto significa que cada orbital puede contener sólo dos electrones, y los electrones tienen que oponerse "vueltas."
Así, que estas reglas, aquí se vería lo que nuestro diagrama de energía llena. En primer lugar, a llenar los niveles de energía atómicos (con los seis electrones de Valencia del oxígeno).
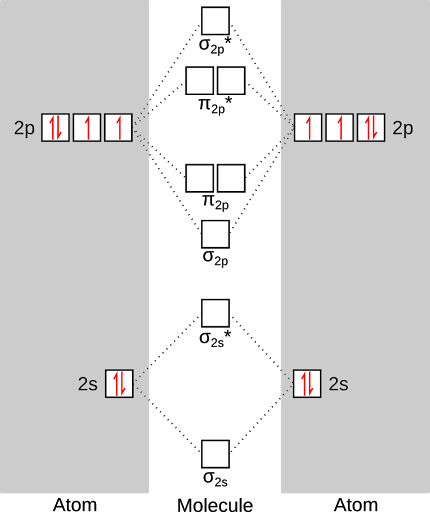
A continuación, a llenar los orbitales moleculares con los doce electrones total aportados por cada oxígeno. Esto nos da el estado de energía más bajo de oxígeno, o el estado de "trío". Observe que hay dos electrones no apareados en la molécula de oxígeno! Por esta razón es tan reactivo oxígeno - los electrones no apareados son solo con ganas de reaccionar.